原标题:中国学者利用基因编辑技术首次获得遗传增强的“超级”干细胞
“金刚狼”、“蜘蛛侠”,这些好莱坞大片里的超级英雄家喻户晓。但在现实生活中,通过基因编辑技术改造生殖细胞,打造出这些遗传增强的“超级人类”被伦理所禁止。而在伦理许可的干细胞中,中国科学家通过基因编辑技术,首次人工改造出遗传增强的“超级”干细胞。这类干细胞或将在治疗人类疾病中展现身手。
7月7日,《细胞研究》(Cell Research)期刊在线发表了中国科学院生物物理研究所刘光慧课题组、北京大学汤富酬课题组和中科院动物研究所曲静课题组的联合研究成果,首次将基因编辑技术用于干细胞的遗传增强,从而宣布了国际上第一例遗传增强人类干细胞(Genetically Enhanced Stem cells,GES细胞)的诞生。
众所周知,干细胞是一类具有自我复制能力的细胞,在一定条件下可以分化成多种功能细胞。那这种新型干细胞又是什么?
在接受澎湃新闻(www.thepaper.cn)采访时,刘光慧介绍说:“‘遗传’意味着干细胞的遗传密码被改变了,我们利用基因编辑技术改写了人类基因组中的单个碱基。这种基因组上的改变在干细胞分裂的过程中,能够稳定地传递给子细胞。”而“增强”指的是,经过这一微小的遗传密码置换,干细胞会“老”得更慢,可以在患者体内存活更长时间,产生更好的再生治疗效果。此外,这种干细胞还能抵抗癌基因的侵扰,从而降低转化为癌细胞的风险。正是因为同时获得了对细胞衰老和癌变的抵抗能力,这种干细胞被称为“遗传增强”的干细胞。
中国科学院动物研究所干细胞与生殖生物学国家重点实验室研究员李伟没有参与这项研究,他向澎湃新闻点评道:“这一发现对间充质干细胞的临床转化治疗具有重要的价值,同时也很好地证实了利用基因编辑技术可以促进干细胞在再生医学中的应用,为干细胞研究提供了值得借鉴的新方法。”
“四两拨千斤”的核心:转录因子“NRF2”
据悉,这种“超级”干细胞是为了解决目前干细胞治疗中的两大难题——治疗有效性和安全性。刘光慧团队及其合作者通过基因编辑技术,仅改变人类基因组中的一个碱基,“四两拨千斤”地破解这两个难题。
而这个“四两拨千斤”的关键改动是围绕着名为“NRF2”的转录因子展开。
转录因子,顾名思义,是指一种可以协助遗传物质DNA向RNA转录的蛋白质。在刘光慧与合作者的工作中,他们以药物筛选的方式,试图找到与干细胞衰老有关的关键因子。这一过程中,他们发现,筛选出来能延缓人类间充质干细胞衰老的化合物有一个共同特点——都能激活NRF2这个抗氧化的转录因子。
由此,刘光慧团队猜测,在基因层面增强NRF2的活性或许能够延缓人类干细胞的衰老。
怎样做最小改动来增强NRF2呢?
在之前的研究中,研究人员已经知道,细胞里有名曰“KEAP1”的NRF2抑制蛋白,会通过结合并降解NRF2,使其无法发挥功能。与此同时,研究人员也已经知晓,在NRF2与其抑制蛋白接触的表面上,有一个氨基酸很关键,负责将NRF2捆绑在抑制蛋白上。
那么,如果这个关键的氨基酸被替换掉,NRF2是不是就能脱离抑制蛋白的束缚,更好地发挥功能,保护细胞了?
“一石二鸟”
于是,为了证明这一猜想,在人类胚胎干细胞中,刘光慧团队使用第三代腺病毒载体HDAdV介导的基因编辑技术,置换了NRF2编码基因的一个碱基(A245G)。置换后,NRF2果然得以挣脱抑制蛋白的“控制”,大量进入细胞核,激活一系列抗氧化和细胞保护基因的表达,使得干细胞有了更长的“寿命”。
随后,刘光慧团队及其合作者测试了这种经过人工改造的干细胞在体内的移植效果。值得一提的是,在干细胞治疗中,胚胎干细胞因为会形成良性的畸胎瘤而无法被直接使用,由胚胎干细胞定向诱导分化而成的间充质干细胞是更佳的治疗材料。

研究人员从液氮罐中取出干细胞。
因此,刘光慧团队从上述改造过的人类胚胎干细胞中分化获得间充质干细胞,并在小鼠身上进行实验。实验中,小鼠腿部的大血管被结扎,出现缺血性损伤。于是,实验人员向小鼠腿部注入干细胞,帮助小鼠的伤腿再生出新的血管细胞,重新构建血管系统。结果显示,相比于没有经过基因编辑的干细胞,经过遗传增强的间充质干细胞能更显著地恢复伤腿的血液循环,具有更好的再生治疗能力。
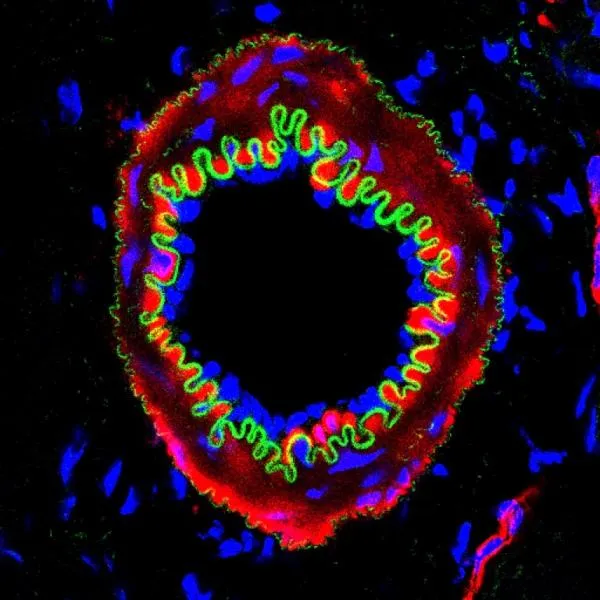
遗传增强人间充质干细胞在小鼠缺血后肢中再生的血管结构。刘光慧供图
效果不错,但有没有安全隐患?这是研究人员无法绕过的科学问题。
紧接着,刘光慧团队及其合作者进行了安全性评估。令他们惊讶的是,经过基因编辑的间充质干细胞虽然具有更强的自我更新能力,但植入小鼠体内后不会形成肿瘤。就算在许多癌基因同时激活的情况下,它也保持着高度的基因组稳定性,对癌基因诱导的细胞恶性转化具有很强的“抵抗力”。
更没想到的是,对于胚胎干细胞会出现畸胎瘤这一问题,他们发现,比起普通的胚胎干细胞,经过基因编辑的胚胎干细胞产生畸胎瘤的能力大大被削弱,进一步在治疗“安全性”上增加了筹码。
总而言之,通过仅仅置换NRF2编码基因的一个碱基,干细胞既获得了更强的再生修复能力,又在很大程度上减少了安全隐患,可谓“一石二鸟”。
遗传增强的策略可标准化、规模化、个性化
这类遗传增强的“超级”干细胞具有可标准化和可规模化的优势,未来或可适用于多种治疗场景。目前,研究人员已经就这项技术申请了发明专利。
但刘光慧也对澎湃新闻谨慎表示,他们猜想,这类细胞的使用应该是有限制的。目前他们已经证明这一遗传增强策略在人类间充质干细胞和血管内皮细胞上适用,但尚未在所有细胞类型中检测它的有效性和安全性。例如,神经干细胞的自我更新需要活性氧,而抗氧化转录因子NRF2增强后,神经干细胞会不会受益?这尚是一个问号。
“我们身体中的任何一种细胞类型,理论上都有它们喜爱的独特的内外环境。”刘光慧说,类似神经干细胞的遗传增强策略可另做个性化设计。
中国科学院上海生命科学研究院营养科学研究所研究员丁秋蓉未参与该项研究,她对澎湃新闻表示,刘光慧及其合作者提出的对干细胞进行“遗传增强”的策略具有很广泛的应用前景。
“(这)可广泛用于再生医学,加强对干细胞移植物的调控,使其更好地和组织工程等技术融合,在体外细胞大规模制备、类器官功能模块构建,体内定向分化、移植入类器官血管化和神经化进程、机体微环境改善和组织修复等过程中更具导向性和可控性,促进其临床转化。”丁秋蓉说。
“当然,遗传密码的改变需要很慎重,需要在基于对修改后细胞特性充分认识,体内安全性充分评价的基础上进行。”丁秋蓉补充说。
