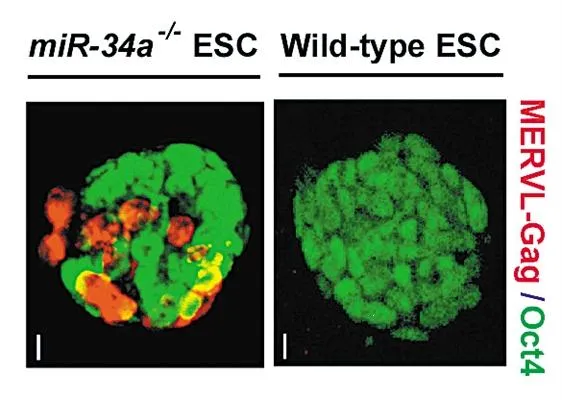
 移除miR-34a的胚胎干细胞(红色)与正常胚胎干细胞的发育区别明显。 图片来源:何琳实验室
移除miR-34a的胚胎干细胞(红色)与正常胚胎干细胞的发育区别明显。 图片来源:何琳实验室美国加州大学伯克利分校分子和细胞生物学副教授何琳带领团队,通过移除一种名叫miR-34a的微RNA,成功让老鼠胚胎干细胞表现出类似受精卵的发育特性,能够成功分化成胚胎组织和胚胎外组织。何琳教授16日通过电子邮件接受科技日报记者采访时表示,这一新的干细胞类型将帮助科学家从分子水平研究早期胚胎的首批发育情况,进而可用干细胞培育出更多组织。发表在《科学》杂志预印版上的这项研究对再生医学和干细胞疗法具有重要意义。
胚胎干细胞和利用成熟体细胞培育出的诱导多能干细胞,只能表现出“多能性”,发育出胚胎内组织,但受精卵是最原始的“全能型”细胞,还能发育出胎盘和卵黄囊等胚胎外组织,为母体与胎儿之间的营养交换和代谢提供支持。
何琳团队不仅揭示出获得全能干细胞的全新机制,而且还提供了对这些细胞深入研究的细胞培养体系。“有了这些实验系统,科学家们能仔细分析胚胎在选择发育成哪种组织时的关键分子通道,这些认知对培育胚胎干细胞和诱导多能干细胞意义重大。受精卵细胞只在精子和卵子受精后短暂存在,难以展开研究,而我们这次提供了一种强大的细胞培养实验体系。”何琳教授说。
微RNA是一类不能转录成蛋白质的非编码RNA,被认为对基因表达调控至关重要。何琳团队发现,miR-34a像“刹车”装置,能阻止多能性干细胞发育出胚胎外组织,将其移除后,约20%的胚胎干细胞也能发育出胎盘和卵黄囊等细胞,并且这种全能型能维持一个月之久。
他们还意外发现,miR-34a与一类特殊的逆转录因子存在关联。逆转录因子被认为是“垃圾DNA”,是从祖辈开始插入基因组内的外来DNA片段。几十年来,科学家们一直认为这些“垃圾DNA”不会对正常发育造成影响,但这次的研究发现,它们与早期胚胎的发育选择紧密相关。
