本期展示的依然是那些美丽和炸裂的实验动图,戴好护目镜,我们要出发了!
例行警告:图多杀猫,没有连上 Wi-Fi 的手机党请迅速关闭此页面!
手套难挡浓硝酸

原理:丁腈手套恐怕是实验室用得最多的手套了,它可以保护我们可爱的双手。但实际上,很多有害物质也是这种手套招架不住的——比如,发烟硝酸。
丁腈橡胶是由丁二烯和丙烯腈聚合而成,高分子链中含有较多的碳碳双键结构,这种结构不耐强氧化剂。发烟硝酸作为一种强氧化剂可以剧烈地和丁腈手套反应,很可能源于对碳碳双键结构的迅速氧化。结果就是反应大量放热,直至燃烧。有文献报道过结构与丁腈橡胶相近的丁苯橡胶,在被硝酸氧化后,碳碳双键会断裂形成醛、酸等产物。
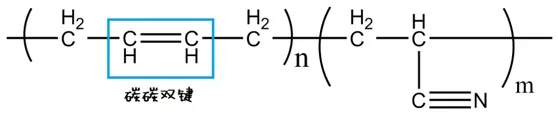
丁腈橡胶的化学结构。原图来自:wikipedia
花絮:丁腈手套对于二氯甲烷、三氯甲烷等有毒溶剂也是不耐受的,溶剂会轻而易举的透过手套,所以不能指望用这种手套防御它们。另外,带着丁腈手套操作发烟硝酸,如果不慎接触,反而可能因为丁腈手套的剧烈反应而受到更大的伤害。因此,如果只有丁腈手套,操作发烟硝酸时不如不戴。徒手不慎接触发烟硝酸的话,应该立即清洗,不会造成严重的灼伤。
危险:中高。发烟硝酸有很强的氧化性,必须在专业实验室中谨慎操作。
录制者:Nile Red
冷色暖色眨眼变

原理:黄色半圆部分浸有一种荧光物质(吡啶碘化亚铜),可以在紫外光下发出黄色荧光。而雾气氤氲的小碗里面装的是-195℃的液氮。将小圆片从液氮取出后,随着温度的上升,蓝色荧光又恢复黄色了。显然,荧光颜色的变化来自于温度的改变。
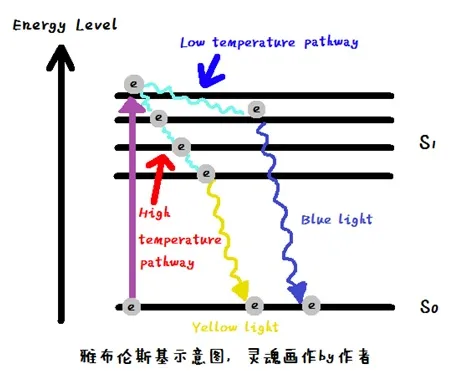
结合上面粗糙简化版的雅布伦斯基图,我们可以一探荧光变色的究竟。荧光分子在受到光(如紫外光)激发后,电子会从能量最低的状态S0飞到能量较高的状态S1(图中紫色箭头过程)。S1这个状态如果细分的话,还有很多能量逐级降低的状态。在温度较高时,电子可以通过一个不发光的过程从S1的最高能级逐步损失能量,掉落至S1的最低能级,这个过程叫分子热振动。最后,伴随着能量以发出荧光的方式放出,电子回到最低能级S0。如果温度很低,那么分子热振动会被大幅度的抑制,因此电子在S1的高能级态就不会因为热振动而损失太多能量。当电子回到最低能级S0时,释放的能量会更多,对应的荧光波长也就更短。对比高温途径和低温途径,放出能量较少的高温途径就对应着黄光,而放出能量较多的低温途径就对应着蓝光了。
花絮:荧光是个很酷的东西。灵敏度高,又容易受到温度、pH 的影响,甚至是荧光基团附近的化学环境都可以影响到荧光的变化以及有无。在科研和生活中,荧光的应用例子多到数不过来,研究者们甚至还能用荧光蛋白在大脑中编织出一道“彩虹”。
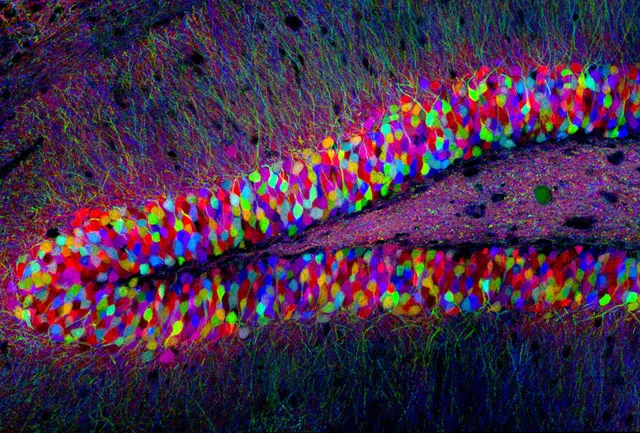
图片来自:Tamily Weissman, Harvard University
危险:较低。使用紫外灯要注意对眼睛的防护,液氮低温,小心别冻伤。
录制者:NurdRage
见风使舵千般色

原理:大塑料杯里的“蓝黑墨水”其实是百里酚蓝溶液,这里展示的是它在不同 pH 下的多变色彩。百里酚蓝可以称得上是酸碱指示剂里的多面手。它的两个变色点源于可以先后解离出两个质子。在 pH 很低的情况下(< 1.2),百里酚蓝显示红色;在 pH 适中时(2.8 ~ 8.0),显示黄色;在 pH 较高时(> 9.6),显示蓝色。而橙色和蓝黑色则是两种状态共存时显示的混合色。
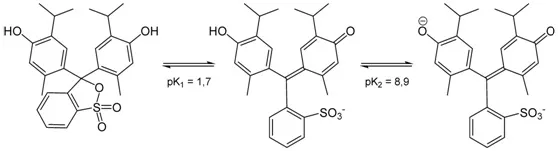
百里酚蓝不同颜色对应的化学结构变化。图片来自:wikipedia
花絮:石蕊,酚酞,甲基橙,甲基红……你还能说出更多酸碱指示剂吗?

想要居家指示剂?你还可以来棵紫甘蓝~图片来自:The Science Kiddo
危险:低,别不小心喝掉就好。
录制者:MEL Science
苦读借光磷火前

原理:在巨大的圆底烧瓶中预先加入了液氧,并气化为氧气,底部还有一小块白磷。经过加热的金属棒引燃氧气中的白磷,反应发出强光。虽然燃烧时间有限,不过反应瓶的明亮程度甚至都可以用来照明了。
花絮:俗称“鬼火”的火光并不是来自白磷的燃烧,目前最有可能的解释是,鬼火源自尸体分解产生的磷化氢的自燃。另外,白磷还有着“很有味道”的发现史,它是炼金术士们炼尿时首次被观察到的……
危险:高。白磷本身就是种危险品,燃烧生成的五氧化二磷白烟如果误吸刺激性也很强。另外五氧化二磷是一种吸水性极强的固体,吸水后会生成偏磷酸,也有较强刺激性,还有剧毒。作为亲身体验过这股白烟的人,强烈建议大家不要模仿。
录制者:Jakob Fuchs
(Lonnie’s Lab 的这一系列演示都相当有趣,下面介绍的几个动图内容也来自他们)
零食一口千焦热

原理:食物的热量是如何测得的?一种经典的方式就是把它烧掉——当然,并是不像上面这么壮烈的方式……
在大烧杯里装着液氧,而加进去的东西则是一块预先点燃的甜甜圈。甜甜圈富含淀粉、糖等有机物,它们在液氧中剧烈地燃烧起来。当我们吃下甜甜圈,身体也是利用氧化还原反应来获取能量,只不过细胞里的反应要缓和得多。
花絮:在液氧里面烧东西会使视觉效果提升若干数量级,当然,危险指数也是一样。在《火星救援》里面,液氧 糖就足以做成威力十足的炸弹了。
危险:高。液氧和可燃物在一起的效果十分炸裂,还是温柔对待你手中的甜甜圈吧。
录制者:Jakob Fuchs
自制食盐别样鲜

原理:金属钠被加热后,放入充有氯气的容器中,伴随着夕阳暮云遮一般的钠特征黄光,氯化钠便生成了。钠在氯气中燃烧,把电子转给了氯,于是钠变成了钠离子,氯变成了氯离子,通过静电力吸在一起。燃烧过后,容器中的浓烟就是氯化钠颗粒:

在原视频中,老爷爷甚至还现场掏出鸡蛋,蘸着事先纯化过的“自制食盐”吃了起来:

且慢,烟为啥是棕色?原视频中并没有给出解释,据我推测,这种颜色可能是来自杂质,或者晶格缺陷产生的色心,另外剧烈燃烧产生的氯化钠颗粒会比较细小,无色的晶体在粒径大幅度减小时,也可能产生不同于大块晶体的颜色。
花絮:在人们对原子结构还没有充分认识之前,有一个理论认为,钠原子是带有“小孔”的,氯原子是带有“小钩”的。所以钠原子和氯原子化合,就是氯原子用小钩钩住了钠原子的小孔。氯原子和氯原子因为可以通过小钩互相钩住,所以可以形成 Cl2;而小孔和小孔没法连在一起,所以没有 Na2。现在看来也是一个神奇的脑洞……
危险:高。钠很活泼,氯气很毒,弄个盐不用这么费事吧……
录制者:UCBerkeley
杯水防火谈笑间


原理:第一张动图显示的是纸巾在异丙醇中浸泡后点燃的效果。根据原视频的说法,这里使用的是一种特殊的“纸巾”,燃点在 500℃以上,可是异丙醇的燃烧会大量放热,于是无辜的纸巾在温度急速上升的凶猛火势中很快就覆灭了。而第二张图中的纸巾是在水和异丙醇的1:1 混合液中浸泡的。这一次,燃烧温度低了很多,直到燃烧结束纸也完好无损,甚至摸一摸也不会烫手。
为什么差异会这么大呢?原因就在于,在燃烧的过程中,水会气化。水的气化热大约是 40 kJ/mol,也就是 2260 kJ/kg。这是一个很大的数值,要知道通常情况下水的比热容才 4.2 kJ/kg 左右。也就是说,把 5 千克的水从0℃加热到 100℃,消耗的热量将将够把 1 千克 100℃的水蒸发成 100℃的蒸气。在异丙醇燃烧的过程中,水被加热蒸发,带走了大量的热,所以温度并不会上升很多,纸巾也就安然无恙了。
花絮:虽然水的比热容比气化热小了很多,但是在常见物质中,这已经是一个很大的数值了。纸杯烧水的小实验也是利用了水较大的比热容来防止纸杯被蜡烛点燃。
危险:高。异丙醇的燃烧很剧烈,玩儿火是很危险的。
录制者:Jakob Fuchs
文章题图:shutterstock 友情提供
编辑:窗敲雨
作者:冬鼠包
本文版权属于果壳网(guokr.com),禁止转载。如有需要,请联系 [email protected]
