
本文来自微信公众号:知识分子(The-Intellectual),作者:田埂,虎嗅获授权发表。
备受关注的“国家级”科研项目“精准医疗计划”,近期遭遇到了两年来最大的舆论风波,来自顶级学术杂志《自然》和《新英格兰医学》的两篇报道,似乎在表示精准医疗概念被“滥用”,肿瘤精准医疗理念的“失败”。
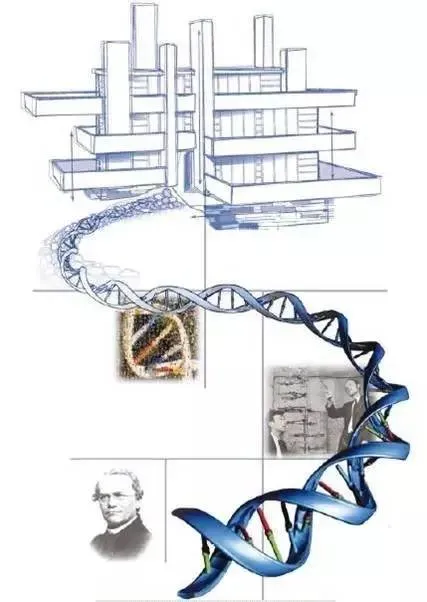
基因组学的发展历程,图片来自,Collins et al., 2003
一个由科学界二十余年工作延续而来的精准医疗计划(Precision Medicine Initiative)是人类对医学理想的“海市蜃楼”,还是真的能构建人类未来健康与医学高楼大厦的基础?这一问题再次成为舆论热点。
精准医疗计划的冷思考

“精准医疗计划”在2015年初由美国总统奥巴马提出
“精准医疗计划”是2015年初由美国总统奥巴马提出来的。在奥巴马看来,精准医疗建立在了解个体的基因、环境以及生活方式的基础上,是一个新兴的疾病治疗和预防的方法。而精准医疗计划则会将精准医学的概念推到临床应用,惠及广大患者。
事实上,“精准医疗”字面的含义则更加宽泛,我们可以将所有可能的提高医学诊断和治疗准确程度的方法都归类为“精准医疗”,包括各种组学和临床医学手段。而我们今天讨论的,更多的则是跟“精准医疗计划”相关的内容。
美国版本的“精准医疗计划”是将遗传和基因组信息应用于临床的计划。2015年1月20日,美国总统奥巴马提出精准医疗计划,人们可以看到的最重要的事件,就是百万人基因组计划。因此,美版的精准医疗计划,在很多场合被称为一个人类基因组测序计划。计划公布之后,2015年内美国启动了一系列的实际动作:
7月12日,NCI提出NCI-MATCH;
8月5日,FDA提出“精准FDA”;
9月17日,精准医疗计划工作小组向NIH院长Francis Collins递交工作报告;
11月20日,确认7800万美元拨款计划。
到2016年2月25日,开始在线招募百万名志愿者,计划在未来的5年招募100万志愿者来测序自己的基因组。
最近的讨论,大都来自“精准医疗计划”的第一个项目,也就是NCI-MATCH计划,即由美国国立卫生研究院(National Cancer Institute,NCI)应精准医疗计划的提议提出的一个计划,英文全称“Molecular Analysis for Therapy Choice”,即“根据分子分析来进行治疗决策”的计划,最初的研究内容包括:
招募3000名病人,1000名合格的入组病人;
20到25种药物;
143个基因的4000个基因突变;
招募10组志愿者;
包括:脑、乳腺、胃肠道、泌尿、头颈、血液、淋巴、黑素瘤、骨髓瘤等。
而这一试验来自于被提及已久的两个概念,即:“篮子试验”和“雨伞试验”。
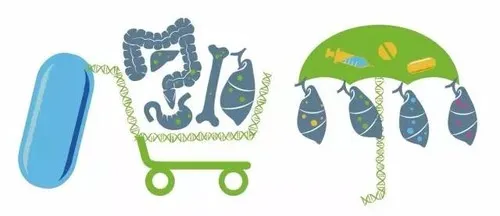
药物实验的篮子和伞试验
“篮子试验”是指将某种靶点明确的药物看作一个篮子,将带有相同靶基因的不同癌症放进这个篮子里进行研究;用一种药物治疗不同的肿瘤,类似于“异病同治”。
“雨伞试验”是指同一种疾病基于不同驱动基因分型的临床研究;类似于“同病异治”对病理分型类似的肿瘤,通过分子分析进行分子分型,进行不同的治疗。
Nature和NEJM两篇文章的批评都对吗?

《自然》(Nature)杂志的批评文章
事实上,此次向精准医疗“开火”的两篇文章,基本上集中在“雨伞试验”的阶段性临床试验结果。
《自然》杂志那篇题“The precision-oncology illusion”的文章指出,“it had only been able to pair 2% of patients with a targeted therapy”,从而得出结论:“精准医疗的理论有效性很低”。其实NCI-MATCH计划自2015年8月开始招募首批795名志愿者。经过检测,9%(预估值是10%)的志愿者的基因突变可匹配10种试验组的一种治疗方案。
但因为一开始入组时条件筛选问题,某些病人不满足各种治疗条件,比如通过入组病人已开始了别的治疗,或病情恶化甚至死亡,最终只有2.5%的患者进入了最终的临床试验,并取得了不错的进展。这就是《自然》文章中“2%”的由来。
从科学性上来说,9%是一个更客观、更有实际指导意义的数值。也就是说9%的病人其实是可能通过“篮子试验”获益,原文作者显然忽略了这一数值的重要意义。
据首期试验的成效分析,NCI-MATCH项目组认为,项目本身预设的结果是有效的,并于2016年5月起将新一批招募规模增加至5000人,药物由10组增加到24组,由此也推算出突变匹配率将会升高至23%,也就是在一线治疗方案失败后,23%的病人将重获治疗的希望。
根据Foundation Medicine公司在2012至2015年对近7000名非小细胞肺癌患者的研究发现,71%的病人身上可以找到美国国立综合癌症网络(NCCN)指南所包含的某个基因变异及对应的靶向治疗方案,NCCN每年会发布各种恶性肿瘤的临床指南,得到全球医生的认可和遵循。
在今年6月份美国临床肿瘤协会(ASCO)的年度会议上,液体活检公司Guardant Health报告了一项包含大于15000例晚期癌症患者的研究。研究者从近400个样本的组织和血液(ctDNA)中发现,突变的总体准确率为87%;当两者收集时间差在6个月内时,准确率达到98%。同时当非小细胞肺癌患者不能进行组织活检时,ctDNA液体活检使可用的生物标志物增多了42%,这是传统方法无法想象的。虽然目前获批的肿瘤靶向药只有几十个,但每种药都可以明显改善癌症病人的生存质量和生存时间。《新英格兰医学》杂志的这篇文章也忽略了这些重要的进展。

《新英格兰医学》(New England Journal of Medicine)杂志的批评文章
精准医学的应用前景:免疫治疗、遗传筛查
近两年,免疫治疗飞速发展,虽然适用的有效人群似乎也一直被诟病,但在2015年《新英格兰医学》杂志发表了一篇关于错配修复患者进行PD-1治疗后肿瘤缩小的文章,引起业内关注。对于PD-1这种免疫治疗方法而言,如果患者存在错配修复功能的缺失,70%的患者可以从治疗中受益。这也是因为错配修复机制缺失意味着更多的随机突变,这些突变被免疫系统认为是外来入侵,因此免疫系统激活而攻击肿瘤细胞。
在美国、英国、荷兰启动的精准医疗相关项目,大规模人群的基因组研究是重点。而大规模人群的研究最直接的获益,就是单基因遗传病的检测。世界卫生组织(WHO)统计的单基因病发病率为0.65%,在美国,一个遗传病的诊断时间大约为4年。随着基因组技术的发展,单基因病的检测速度在加速。
近两年,NEJM、JAMA及Science Translational Medicine杂志的研究证实了全外显子测序的临床诊断率为25%-45%。也就是通过精准医疗的方法,有超过1/4的机会可以找到病因。而随着精准医疗计划等基因组计划积累的数据,如果增加全基因组测序的方法,可诊断的罕见病的比例则更高。最近,炙手可热的无创产前技术,已淘汰了传统的血清学筛查,成为一线的检测方案,并使得通过无创的方法进行胎儿遗传病的检测成为未来可能全民推广的技术。
如果时间回到2003年,当FrancsCollins在《自然》杂志上发表“A vision for the future of genomics research”时,描绘着在基因组学基础上,人类建筑的高楼大厦,那时的基因测序技术和成本,让这一场景还只是“海市蜃楼”。而2015年,奥巴马提出“精准医疗计划”,并在千元基因组已实现的大背景下,给我们描绘了一个更加具体、可操作的基因组医学的未来,这就是通过基因组技术让医学更加“精准”。
抛开对“精准”本身概念的不同理解,遗传和基因组分析手段进入临床的时代已不可逆转,即便是“海市蜃楼”,最终也会一部分一部分逐渐变成现实。波折是发展过程中必将出现的,也正是因为这些波折,才会去伪存真,让真正有价值的知识和信息沉淀下来。
参考文献 :
1. Collins,F. S., et al. (2003). "A vision for the future of genomics research."Nature 422(6934): 835-847.
2. VinayPrasad (2016)“Perspective: The precision-oncologyillusion” Nature 537, S63
3. Ian F et al. (2016) “Limits to Personalized Cancer Medicine” . N Engl J Med 375:1289-1294.
4.Le DTet al.(2015)“PD-1Blockade in Tumors with Mismatch-Repair Deficiency” N Engl J Med 372:2509-2520.
5. Suh,JH et al. (2016)“Comprehensive Genomic Profiling FacilitatesImplementation of the National Comprehensive Cancer Network Guidelines for LungCancer Biomarker Testing and Identifies Patients Who May Benefit FromEnrollment in Mechanism-Driven Clinical Trials. ”TheOncologist;21(6): 684-91.
6. YangY et al. (2013)“Clinical whole-exome sequencing for thediagnosis of Mendelian disorders” NEngl J Med. 369(16):1502-11.
7. Lee H et al.(2014)“Clinical exomesequencing for genetic identification of rare Mendelian disorders” JAMA. 312(18):1880-7.
8. Taylor JCet al.(2015)“Factorsinfluencing success of clinical genome sequencing across a broad spectrum ofdisorders.”Nat Genet. 47(7):717-26.
